Danh mục 418 thuốc sản xuất trong nước được gia hạn giấy đăng ký lưu hành tại Việt Nam hiệu lực 05 năm - Đợt 200 mới nhất 2024?
Danh mục 418 thuốc sản xuất trong nước được gia hạn giấy đăng ký lưu hành tại Việt Nam hiệu lực 05 năm - Đợt 200 mới nhất 2024?
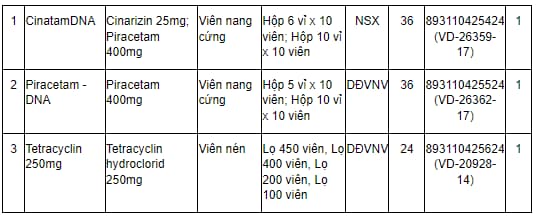
Căn cứ theo Phụ lục I ban hành kèm theo Quyết định 401/QĐ-QLD năm 2024 của Cục Quản lý Dược có nêu Danh mục 418 thuốc sản xuất trong nước được gia hạn giấy đăng ký lưu hành tại Việt Nam hiệu lực 05 năm - Đợt 200 như sau:
Dưới đây là Danh mục 418 thuốc sản xuất trong nước được gia hạn giấy đăng ký lưu hành tại Việt Nam hiệu lực 05 năm - Đợt 200:
- Cơ sở đăng ký: Công ty cổ phần Dược - Vật tư y tế Nghệ An (Địa chỉ: Số 68 đường Nguyễn Sỹ Sách, Phường Hưng Phúc, thành phố Vinh, tỉnh Nghệ An, Việt Nam)
- Cơ sở sản xuất: Công ty cổ phần Dược - Vật tư y tế Nghệ An (Địa chỉ: Số 68 đường Nguyễn Sỹ Sách, Phường Hưng Phúc, thành phố Vinh, tỉnh Nghệ An, Việt Nam)
- Cơ sở đăng ký: Công ty cổ phần dược Apimed (Địa chỉ: 263/9 Lý Thường Kiệt, Phường 15, Quận 11, Thành phố Hồ Chí Minh, Việt Nam)
- Cơ sở sản xuất: Công ty cổ phần dược Apimed (Địa chỉ: Đường N1, cụm công nghiệp Phú Thạnh - Vĩnh Thanh, xã Vĩnh Thanh, huyện Nhơn Trạch, tỉnh Đồng Nai, Việt Nam)
>> Xem chi tiết Danh mục 418 thuốc sản xuất trong nước được gia hạn giấy đăng ký lưu hành tại Việt Nam hiệu lực 05 năm - Đợt 200: Tải về

Danh mục 418 thuốc sản xuất trong nước được gia hạn giấy đăng ký lưu hành tại Việt Nam hiệu lực 05 năm - Đợt 200 mới nhất 2024? (Hình ảnh Internet)
Trách nhiệm của cơ sở sản xuất và cơ sở đăng ký thuốc như thế nào?
Căn cứ Điều 2 Quyết định 401/QĐ-QLD năm 2024, cơ sở sản xuất và cơ sở đăng ký thuốc có trách nhiệm như sau:
- Sản xuất thuốc theo đúng các hồ sơ, tài liệu đã đăng ký với Bộ Y tế và phải in số đăng ký được Bộ Y tế Việt Nam cấp lên nhãn thuốc.
- Chỉ được sản xuất, đưa ra lưu hành các thuốc kiểm soát đặc biệt khi có Giấy chứng nhận đủ điều kiện kinh doanh dược phạm vi kinh doanh thuốc phải kiểm soát đặc biệt phù hợp với phạm vi hoạt động của cơ sở đáp ứng quy định tại khoản 5 Điều 143 Nghị định 54/2017/NĐ-CP.
- Thực hiện việc cập nhật tiêu chuẩn chất lượng của thuốc theo quy định tại Thông tư 11/2018/TT-BYT quy định về chất lượng thuốc, nguyên liệu làm thuốc.
- Thuốc được gia hạn giấy đăng ký lưu hành tại Quyết định 401/QĐ-QLD năm 2024 nhưng chưa nộp hồ sơ cập nhật nội dung nhãn thuốc, tờ hướng dẫn sử dụng thuốc theo quy định của Thông tư 01/2018/TT-BYT thì phải thực hiện cập nhật theo quy định tại điểm b khoản 1 Điều 37 Thông tư 01/2018/TT-BYT trong thời hạn 12 tháng kể từ ngày được gia hạn giấy đăng ký lưu hành.
- Sau 12 tháng kể từ ngày ký ban hành Quyết định 401/QĐ-QLD năm 2024, các thuốc được gia hạn giấy đăng ký lưu hành theo Quyết định 401/QĐ-QLD có thay đổi về nội dung hành chính phải sản xuất và lưu hành với các nội dung đã được phê duyệt thay đổi trong hồ sơ gia hạn.
- Cơ sở đăng ký thuốc phải bảo đảm duy trì điều kiện hoạt động trong thời gian hiệu lực của giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc. Trong trường hợp không còn đáp ứng đủ điều kiện hoạt động, cơ sở đăng ký phải có trách nhiệm thực hiện thay đổi cơ sở đăng ký theo quy định tại Thông tư 08/2022/TT-BYT trong thời hạn 30 ngày kể từ ngày cơ sở đăng ký không còn đủ điều kiện hoạt động.
- Cơ sở sản xuất thuốc phải bảo đảm các điều kiện hoạt động của cơ sở sản xuất trong thời hạn hiệu lực của giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc.
- Các thuốc được gia hạn giấy đăng ký lưu hành tại Quyết định này được tiếp tục sử dụng số đăng ký đã cấp trước khi gia hạn trong thời hạn tối đa 12 tháng kể từ ngày được cấp số đăng ký gia hạn theo quy định tại Phụ lục VI ban hành kèm theo Thông tư 08/2022/TT-BYT.
- Phối hợp với các cơ sở điều trị để thực hiện theo đúng các quy định hiện hành về thuốc kê đơn, theo dõi an toàn, hiệu quả, tác dụng không mong muốn của thuốc trên người Việt Nam và tổng hợp, báo cáo theo quy định tại Điều 5 Thông tư 08/2022/TT-BYT đối với các thuốc trong Phụ lục II ban hành kèm theo Quyết định 401/QĐ-QLD năm 2024.
Trách nhiệm của cơ sở sản xuất thuốc, nguyên liệu làm thuốc ra sao?
Căn cứ khoản 2 Điều 43 Luật Dược 2016 quy định trách nhiệm của cơ sở sản xuất thuốc, nguyên liệu làm thuốc như sau:
Theo đó, cơ sở sản xuất thuốc, nguyên liệu làm thuốc có các trách nhiệm sau đây:
- Trách nhiệm có liên quan quy định tại các điểm a, b, c, d, đ, e, g, h, i, k, l, m và n khoản 2 Điều 42 Luật Dược 2016.
- Sản xuất thuốc, nguyên liệu làm thuốc theo đúng quy trình sản xuất và tiêu chuẩn chất lượng đã đăng ký hoặc công bố.
- Chịu trách nhiệm về nguồn gốc, chất lượng thuốc, nguyên liệu làm thuốc do cơ sở sản xuất và chỉ được phép xuất xưởng thuốc, nguyên liệu làm thuốc đạt tiêu chuẩn chất lượng đã đăng ký.
- Theo dõi chất lượng, an toàn, hiệu quả của thuốc, nguyên liệu làm thuốc do cơ sở sản xuất trong thời gian lưu hành trên thị trường và thu hồi thuốc, nguyên liệu làm thuốc theo quy định Luật Dược 2016.
- Chịu trách nhiệm về số lượng thuốc, nguyên liệu làm thuốc đã nhập khẩu, mua, bán, sử dụng và báo cáo theo quy định của Bộ trưởng Bộ Y tế.







Quý khách cần hỏi thêm thông tin về có thể đặt câu hỏi tại đây.
- Bộ đội địa phương là lực lượng thường trực của Quân đội nhân dân? Chỉ huy cao nhất trong Quân đội nhân dân?
- Việc đăng ký, cấp giấy chứng nhận quyền sở hữu, quyền sử dụng tài sản từ 2025 như thế nào? Tài sản nào không được kê biên trong thi hành án dân sự?
- Concert ATSH đêm 3 và đêm 4 tổ chức tại sân Mỹ Đình được UBND Thành phố Hà Nội thống nhất theo Thông báo 4032?
- Chuyển mục đích sử dụng đất trồng lúa sang đất ở có phải xin phép không? Điều kiện chuyển mục đích sử dụng đất trồng lúa như thế nào?
- Giới nghiêm là biện pháp cấm người đi lại đúng không? Ai ban bố lệnh giới nghiêm tại địa phương cấp tỉnh?









