Danh mục 96 thuốc nước ngoài được cấp giấy đăng ký lưu hành tại Việt Nam Đợt 114.3 gồm những thuốc nào?
Quyết định 452/QĐ-QLD năm 2023 về Danh mục 96 thuốc nước ngoài được cấp giấy đăng ký lưu hành tại Việt Nam - Đợt 114.3 do Cục trưởng Cục Quản lý Dược ban hành ngày 28/6/2023.
Danh mục 96 thuốc nước ngoài được cấp giấy đăng ký lưu hành tại Việt Nam Đợt 114.3 gồm những thuốc nào?
Theo đó, ban hành kèm theo Quyết định 452/QĐ-QLD năm 2023 là danh mục 96 thuốc nước ngoài được cấp, gia hạn giấy đăng ký lưu hành tại Việt Nam - Đợt 114.3, bao gồm:
1. Danh mục 79 thuốc nước ngoài được cấp giấy đăng ký lưu hành hiệu lực 05 năm - Đợt 114.3 (tại Phụ lục I kèm theo). TẢI VỀ
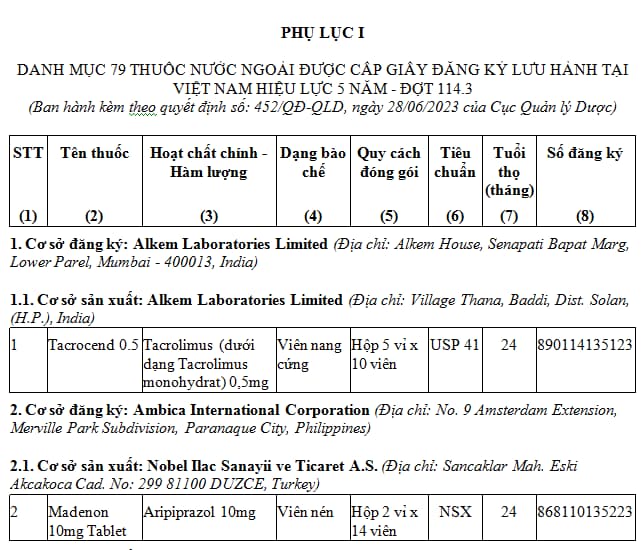
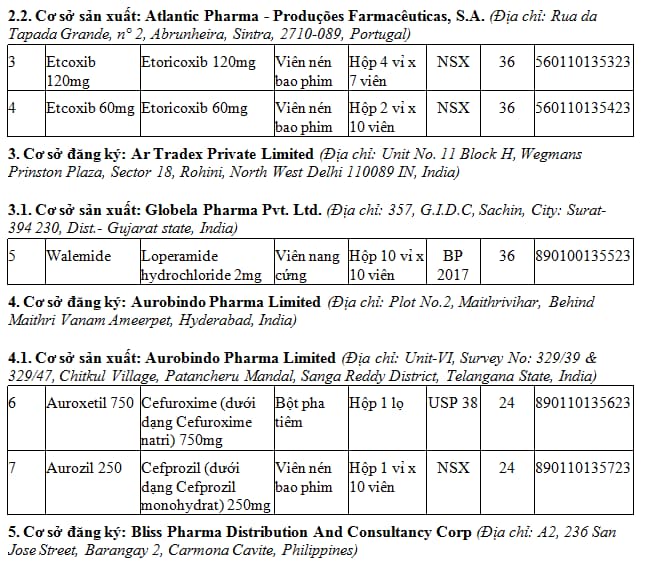
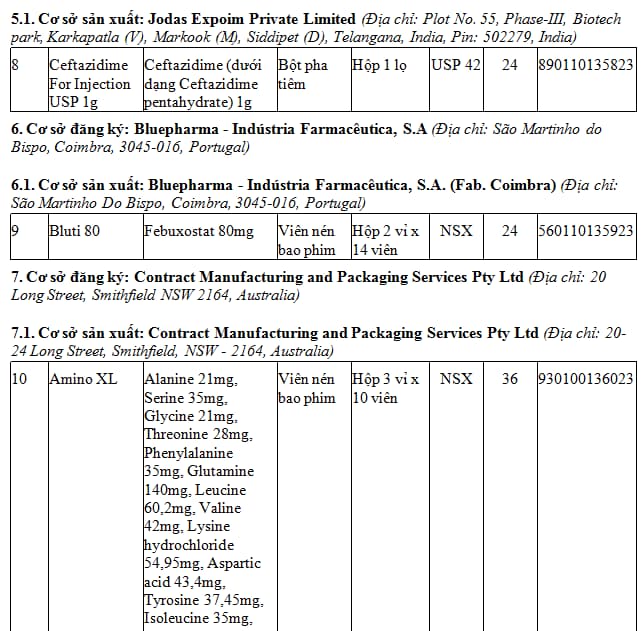
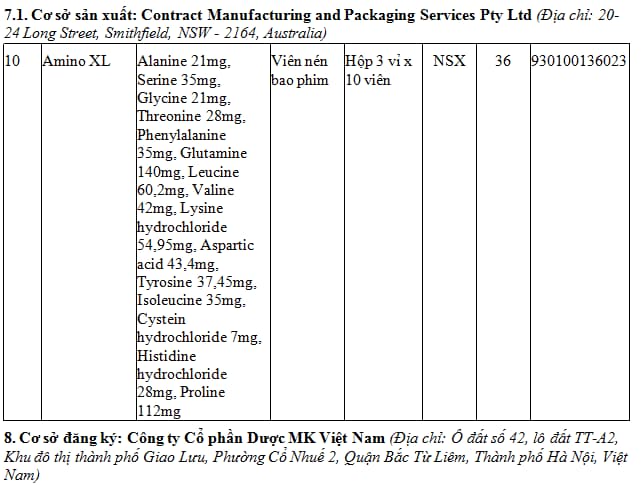
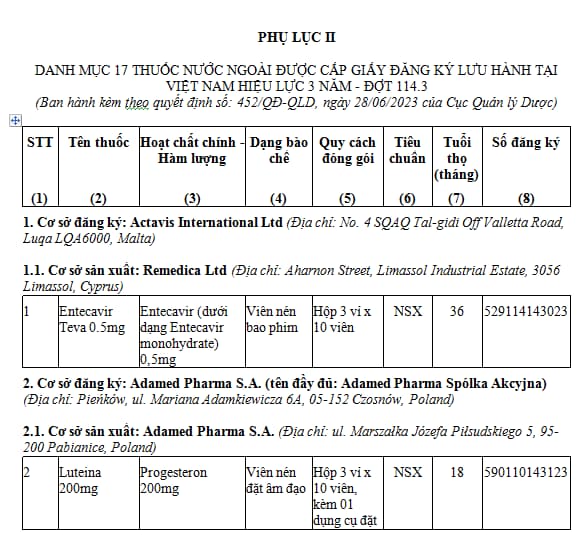
2. Danh mục 17 thuốc nước ngoài được cấp giấy đăng ký lưu hành hiệu lực 03 năm - Đợt 114.3 (tại Phụ lục II kèm theo). TẢI VỀ
Danh mục 96 thuốc nước ngoài được cấp giấy đăng ký lưu hành tại Việt Nam Đợt 114.3 gồm những thuốc nào? (Hình internet)
Trách nhiệm của Cơ sở sản xuất và cơ sở đăng ký thuốc là gì?
Tại Điều 2 Quyết định 452/QĐ-QLD năm 2023 quy định Cơ sở sản xuất và cơ sở đăng ký thuốc có trách nhiệm:
- Cung cấp thuốc vào Việt Nam theo đúng các hồ sơ tài liệu đã đăng ký với Bộ Y tế và phải in hoặc dán số đăng ký được Bộ Y tế cấp lên nhãn thuốc.
- Chấp hành đầy đủ pháp luật của nước CHXHCN Việt Nam và các quy định của Bộ Y tế về nhập khẩu thuốc và lưu hành thuốc tại Việt Nam, nếu có bất cứ thay đổi gì trong quá trình lưu hành thuốc ở nước sở tại và ở Việt Nam thì phải báo cáo ngay cho Cục Quản lý Dược - Bộ Y tế Việt Nam.
- Thực hiện việc cập nhật tiêu chuẩn chất lượng của thuốc theo quy định tại Thông tư 11/2018/TT-BYT quy định về chất lượng thuốc, nguyên liệu làm thuốc.
- Cập nhật nhãn thuốc và tờ hướng dẫn sử dụng thuốc theo quy định tại Thông tư 01/2018/TT-BYT quy định ghi nhãn thuốc, nguyên liệu làm thuốc và tờ hướng dẫn sử dụng thuốc theo hình thức thay đổi, bổ sung giấy đăng ký lưu hành thuốc quy định tại Thông tư 08/2022/TT-BYT đối với thuốc chưa cập nhật nội dung nhãn thuốc, tờ hướng dẫn sử dụng thuốc theo quy định tại Thông tư 01/2018/TT-BYT, cụ thể như sau:
+ Đối với thuốc thuộc danh mục thuốc độc và nguyên liệu độc làm thuốc theo quy định tại Thông tư 06/2017/TT-BYT về việc ban hành danh mục thuốc độc và nguyên liệu độc làm thuốc: chỉ được lưu hành sau khi cập nhật theo quy định tại điểm b Khoản 1 Điều 37 Thông tư 01/2018/TT-BYT quy định ghi nhãn thuốc, nguyên liệu làm thuốc và tờ hướng dẫn sử dụng thuốc.
+ Đối với các thuốc khác phải thực hiện việc cập nhật này trong thời hạn 12 tháng kể từ ngày được cấp giấy đăng ký lưu hành.
- Phối hợp với các cơ sở điều trị để thực hiện theo đúng các quy định hiện hành về thuốc kê đơn, theo dõi an toàn, hiệu quả, tác dụng không mong muốn của thuốc trên người Việt Nam và tổng hợp, báo cáo theo quy định tại Điều 5 Thông tư 08/2022/TT-BYT quy định việc đăng ký lưu hành thuốc, nguyên liệu làm thuốc đối với các thuốc thuộc Danh mục tại Phụ lục II ban hành kèm theo Quyết định này.
- Cơ sở đăng ký phải đảm bảo duy trì điều kiện hoạt động của cơ sở đăng ký trong thời gian hiệu lực của giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc. Trong trường hợp không còn đáp ứng đủ điều kiện hoạt động, cơ sở đăng ký phải có trách nhiệm thực hiện thay đổi cơ sở đăng ký theo quy định tại Thông tư 08/2022/TT-BYT trong thời hạn 30 ngày kể từ ngày cơ sở đăng ký không còn đủ điều kiện hoạt động.
- Cơ sở đăng ký thuốc phải báo cáo Bộ Y tế về cập nhật tình trạng đáp ứng Thực hành tốt sản xuất của cơ sở sản xuất thuốc, nguyên liệu làm thuốc.
Trường hợp cơ sở sản xuất bị thu hồi giấy phép sản xuất hoặc không đáp ứng Thực hành tốt sản xuất thuốc, nguyên liệu làm thuốc ở nước sở tại, cơ sở phải thực hiện việc báo cáo trong thời hạn 15 ngày kể từ ngày có thông báo của cơ quan quản lý có thẩm quyền nước sở tại theo quy định tại điểm d khoản 1 Điều 100 Nghị định 54/2017/NĐ-CP quy định chi tiết một số điều và biện pháp thi hành Luật Dược.
Danh mục 96 thuốc nước ngoài được cấp giấy đăng ký lưu hành tại Việt Nam - Đợt 114.3 được áp dụng khi nào?
Căn cứ quy định tại Điều 3 Quyết định 452/QĐ-QLD năm 2023 có hiệu lực kể từ ngày ký ban hành tức ngày 28/6/2026.
Như vậy, danh mục 96 thuốc nước ngoài được cấp giấy đăng ký lưu hành tại Việt Nam - Đợt 114.3 chính thức từ 28/6/2023.
Bên cạnh đó, Cục trưởng Cục Quản lý Dược yêu cầu Giám đốc Sở Y tế các tỉnh, thành phố trực thuộc trung ương, giám đốc nhà sản xuất và cơ sở đăng ký có thuốc tại Điều 1 Quyết định 452/QĐ-QLD năm 2023 chịu trách nhiệm thi hành Quyết định này.









Quý khách cần hỏi thêm thông tin về có thể đặt câu hỏi tại đây.
- Giờ hoàng đạo Rằm tháng Giêng 2025 tốt? Cúng Rằm tháng Giêng mấy giờ là tốt? Cúng Rằm tháng Giêng 2025 vào ngày nào đẹp?
- Cơ cấu tổ chức của Tòa án nhân dân cấp tỉnh, thành phố trực thuộc trung ương được quy định thế nào?
- Vi phạm quy định về lao động là người giúp việc gia đình bị xử phạt thế nào? Hợp đồng lao động đối với lao động là người giúp việc gia đình?
- Mẫu biên bản họp thành viên hộ gia đình về việc thành lập hộ kinh doanh mới nhất 2025 như thế nào?
- Tổng hợp 10 lời chúc Valentine 14 2 cho bạn trai ngắn gọn, ý nghĩa? Valentine 14 2 có phải ngày lễ lớn?










