Quá trình tách chiết ADN trong phương pháp PCR để phát hiện ký sinh trùng Perkinsus olseni gây bệnh thủy sản ở bào ngư thực hiện ra sao?
- Quá trình tách chiết ADN trong phương pháp PCR để phát hiện ký sinh trùng Perkinsus olseni gây bệnh thủy sản ở bào ngư thực hiện ra sao?
- Sử dụng mẫu ADN sau khi tách chiết để thực hiện phản ứng PCR chẩn đoán bệnh thủy sản ở bào ngư do ký sinh trùng Perkinsus olseni gây ra như thế nào?
- Thiết bị dụng cụ hỗ trợ trong phương pháp PCR để chẩn đoán bệnh thủy sản ở bào ngư do ký sinh trùng Perkinsus olseni gây nên gồm những loại nào?
Quá trình tách chiết ADN trong phương pháp PCR để phát hiện ký sinh trùng Perkinsus olseni gây bệnh thủy sản ở bào ngư thực hiện ra sao?

Bệnh thủy sản ở bào ngư (Hình từ Internet)
Theo Phụ lục B Tiêu chuẩn quốc gia TCVN 8710-11:2015 về Bệnh thủy sản - Quy trình chẩn đoán - Phần 11: Bệnh do Perkinsus olseni ở nhuyễn thể hai mảnh vỏ quy định về quy trình tách chiến ADN như sau:
Quy trình tách chiết ADN sử dụng kít tách chiết DNeasy® Blood & Tissue Kit (250) (Cat No. 69506): và protein K ủ qua đêm ở 56 °C như sau:
- Nhỏ 20 ml protein K vào ống ly tâm 1,5 ml;
- Chuyển 30 mg mẫu bệnh phẩm (6.2.3) vào ống ly tâm đã có protein K;
- Thêm 200 ml dung dịch AL (Lysis buffer);
- Trộn kỹ huyễn dịch trong 15 s, sau đó ly tâm nhanh bằng máy spindown (4.2.4);
- Ủ qua đêm ở 56 °C trong bể ủ nhiệt (4.2.5), sau đó ly tâm nhanh bằng máy spindown (4.2.4)
- Thêm 200 ml ethanol tuyệt đối (3.2.1) vào ống ly tâm;
- Trộn kỹ huyễn dịch trong 15 s, sau đó ly tâm nhanh bằng máy spindown (4.2.4);
- Hút 420 ml huyễn dịch trong ống ly tâm trên, chuyển sang cột ly tâm có ống thu ở dưới;
- Ly tâm bằng máy ly tâm (4.2.2) với gia tốc 6 000 g (8 000 r/min) trong 1 min ở nhiệt độ phòng:
- Thêm 500 ml dung dịch AW1 (Wash buffer 1) vào cột ly tâm có ống thu ở dưới;
- Ly tâm bằng máy ly tâm (4.2.2) với gia tốc 6 000 g (8 000 r/min) trong 1 min ở nhiệt độ phòng;
- Thay ống thu ở dưới cột ly tâm;
- Thêm 500 ml dung dịch AW2 (Wash buffer 2) vào cột ly tâm có ống thu ở dưới;
- Ly tâm bằng máy ly tâm (4.2.2) với gia tốc 20 000 g (14 000 r/min) trong 3 min ở nhiệt độ phòng:
- Chuyển cột ly tâm sang ống ly tâm 1,5 ml;
- Nhỏ 200 ml dung dịch AE (Elution buffer) vào cột ly tâm và giữ ở nhiệt độ phòng 1 min;
- Ly tâm bằng máy ly tâm (4.2.2) với gia tốc 6 000 g (8 000 r/min) trong 1 min;
- Chuyển 200 ml ADN đã thu được sang ống eppendorf 1,5 ml khác.
Bảo quản ADN ở nhiệt độ từ 2 °C đến 8 °C nếu thực hiện phản ứng PCR ngay hoặc ở nhiệt độ âm 20 °C đến âm 80 °C nếu thực hiện phản ứng PCR sau 24 h.
Theo đó, quy trình tách chiết ADN trong phương pháp PCR để phát hiện ký sinh trùng Perkinsus olseni gây bệnh thủy sản ở bào ngư được thực hiện theo quy trình nêu trên.
Sử dụng mẫu ADN sau khi tách chiết để thực hiện phản ứng PCR chẩn đoán bệnh thủy sản ở bào ngư do ký sinh trùng Perkinsus olseni gây ra như thế nào?
Theo tiết 6.2.4 tiểu mục 6.2 Mục 6 Tiêu chuẩn quốc gia TCVN 8710-11:2015 về Bệnh thủy sản - Quy trình chẩn đoán - Phần 11: Bệnh do Perkinsus olseni ở nhuyễn thể hai mảnh vỏ quy định về quy trình thực hiện phản ứng PCR trong phương pháp PCR chẩn đoán bệnh thủy sản ở bào ngư do ký sinh trùng Perkinsus olseni gây nên như sau:
Chẩn đoán trong phòng thí nghiệm
...
6.2. Phương pháp PCR (Polymerase Chain Reaction)
...
6.2.4. Cách tiến hành
...
6.2.4.2. Chuẩn bị mồi
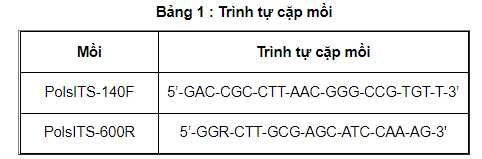
Phản ứng khuếch đại được thực hiện trong máy nhân gen (4.2.1) theo phương pháp PCR khuếch đại đoạn gen đặc hiệu của Perkinsus olseni sử dụng cặp mồi PolsITS-140F và PolsITS-600R (3.2.4). Trình tự cặp mồi được nêu trong Bảng 1.
Cặp mồi PolsITS-140F và PolsITS-600R dùng để khuếch đại đoạn gen của Perkinsus olseni có kích thước 450 bp.
Mồi được chuẩn bị như sau:
Chuẩn bị mồi gốc:
- Mồi gốc ở trạng thái đông khô phải được ly tâm nhanh bằng máy spindown (4.2.4) trong 30 s để mồi lắng xuống đáy ống trước khi mở và hoàn nguyên. Khi hoàn nguyên, nên dùng dung dịch đệm TE (3.2.10) được mồi ở nồng độ 200 mM làm mồi gốc;
Chuẩn bị mồi sử dụng:
- Mồi sử dụng ở nồng độ 20 mM: pha loãng mồi gốc bằng nước (3.2.5) (10 ml mồi gốc và 90 ml nước (3.2.5)).
6.2.4.3. Tiến hành phản ứng PCR
Sử dụng cặp mồi đã được chuẩn bị (6.2.4.2) sử dụng kít nhân gen (3.2.3) theo hướng dẫn của nhà sản xuất.
VÍ DỤ: Sử dụng kít nhân gen của Thermo Scientific Dream Tag PCR Master Mix (2X) (Lot: 00316656)2)
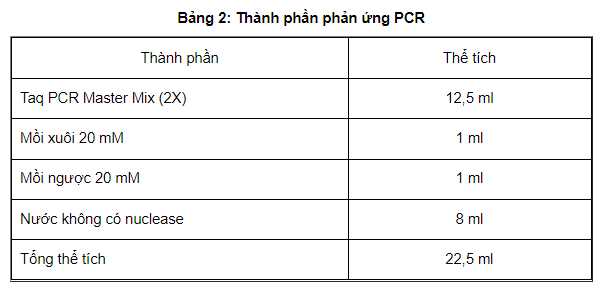
Thành phần cho 1 phản ứng được nêu trong bảng 2
Chuyển 22,5 ml hỗn hợp nhân gen vào mỗi ống phản ứng:
- Mẫu kiểm chứng dương: Cho 2,5 ml mẫu ADN đã được giám định hoặc sử dụng các chủng Perkinsus marinus chuẩn vào ống phản ứng;
- Mẫu kiểm chứng âm: Cho 2,5 ml nước (3.2.5) vào ống phản ứng:
- Mẫu thử: Cho 2,5 ml mẫu ADN kiểm tra vào ống phản ứng.
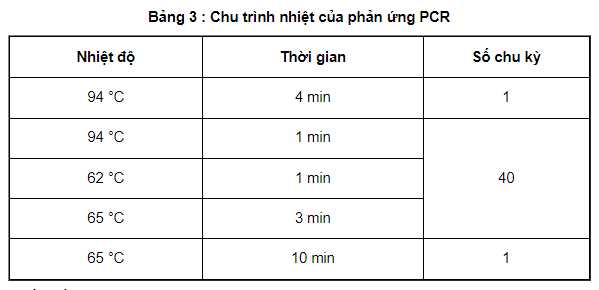
Tiến hành phản ứng PCR bằng máy nhân gen (4.2.1) đã cài đặt chu trình nhiệt được nêu trong bảng 3.
CHÚ THÍCH
- Phản ứng PCR phải bao gồm: mẫu kiểm tra, mẫu kiểm chứng dương và mẫu kiểm chứng âm;
- Mẫu và nguyên liệu cho phản ứng PCR cần đặt trong khay đá lạnh trong suốt quá trình chuẩn bị hỗn hợp phản ứng.
...
Như vậy, sau khi tách chiết được ADN thì cần sử dụng cặp mồi theo quy định để thực hiện phản ứng khuếch đại đoạn gen đặc hiệu của Perkinsus olseni. Sau đó sẽ tiến hành phản ứng PCR trong phương pháp PCR để phát hiện ký sinh trùng Perkinsus olseni theo tiêu chuẩn nêu trên.
Thiết bị dụng cụ hỗ trợ trong phương pháp PCR để chẩn đoán bệnh thủy sản ở bào ngư do ký sinh trùng Perkinsus olseni gây nên gồm những loại nào?
Theo Mục 4 Tiêu chuẩn quốc gia TCVN 8710-11:2015 về Bệnh thủy sản - Quy trình chẩn đoán - Phần 11: Bệnh do Perkinsus olseni ở nhuyễn thể hai mảnh vỏ quy định về thiết bị, dụng cụ dùng trong phương pháp PCR như sau:
Thiết bị, dụng cụ
Sử dụng thiết bị, dụng cụ thông thường của phòng thử nghiệm sinh học và những thiết bị, dụng cụ sau:
4.1. Thiết bị, dụng cụ dùng cho phương pháp nuôi cấy Perkinsus olseni.
4.1.1. Nồi hấp vô trùng, có thể duy trì ở nhiệt độ 115°C.
4.1.2. Kính hiển vi quang học, vật kính 10 X, 20 X, 40 X và 100 X.
4.1.3. Ống nghiệm vô trùng, dung tích 15 ml.
4.1.4. Phiến kính vô trùng.
4.1.5. Lamen vô trùng.
4.1.6. Dao mổ, panh, kéo vô trùng.
4.1.7. Pipet pasteur.
4.2. Thiết bị, dụng cụ dùng cho phương pháp chẩn đoán bằng PCR.
4.2.1. Máy nhân gen (PCR).
4.2.2. Máy ly tâm, có thể ly tâm với gia tốc 6 000 g và 20 000 g.
4.2.3. Máy lắc trộn vortex.
4.2.4. Máy spindown.
4.2.5. Bể ủ nhiệt, duy trì nhiệt độ từ 55 °C đến 60 °C.
4.2.6. Bộ điện di, gồm bộ nguồn và bể chạy điện di.
4.2.7. Máy đọc gel.
4.2.8. Ống eppendorf, dung tích 1,5 ml.
Từ tiêu chuẩn trên thì thiết bị, dụng cụ dùng để hỗ trợ cho việc chẩn đoán bệnh thủy sản ở bào ngư do ký sinh trùng Perkinsus olseni gây nên trong phương pháp PCR gồm:
- Máy nhân gen (PCR).
- Máy ly tâm, có thể ly tâm với gia tốc 6 000 g và 20 000 g.
- Máy lắc trộn vortex.
- Máy spindown.
- Bể ủ nhiệt, duy trì nhiệt độ từ 55 °C đến 60 °C.
- Bộ điện di, gồm bộ nguồn và bể chạy điện di.
- Máy đọc gel.
- Ống eppendorf, dung tích 1,5 ml.

Quý khách cần hỏi thêm thông tin về có thể đặt câu hỏi tại đây.
- Có thể ủy quyền thực hiện thủ tục đăng ký doanh nghiệp cho đơn vị cung cấp dịch vụ bưu chính công ích không?
- Hướng dẫn tính điểm thi đua đối với ban tổ chức các tỉnh, thành ủy, đảng ủy khối trực thuộc trung ương theo Quy định 13?
- Khi nào được cấp lại giấy phép đào tạo lái xe ô tô? Trình tự, hồ sơ cấp lại giấy phép đào tạo lái xe ô tô theo Nghị định 160?
- Mẫu thư trả lời khiếu nại của khách hàng là người tiêu dùng? Thời hạn thông báo cho người tiêu dùng về việc tiếp nhận khiếu nại là bao lâu?
- Số lượng đại biểu chính thức dự đại hội công đoàn tỉnh là bao nhiêu? Điều kiện, tiêu chuẩn đại biểu chính thức dự đại hội?